La prostatectomie radicale reste le traitement de référence du cancer de prostate dans sa forme localisée. Les deux principales séquelles de cette intervention sont la survenue d’une dysfonction érectile et d’une incontinence urinaire par lésion du sphincter strié urétral et/ou modification des propriétés biomécaniques de la vessie. L’augmentation du nombre de prostatectomies radicales réalisées chaque année en raison de la popularisation du dépistage du cancer de prostate s’accompagne d’une recrudescence de patients nécessitant la prise en charge d’une incontinence urinaire, en dépit de l’amélioration constante des techniques chirurgicales. L’objectif de cet article est de donner un aperçu de la physiopathologie et des traitements de l’incontinence après prostatectomie radicale.
Les taux d’incontinence urinaire rapportés après prostatectomie radicale varient considérablement d’une étude à l’autre [1-6]. Plusieurs facteurs expliquent ces discordances : il s’agit essentiellement de la définition de l’incontinence, du moment choisi pour évaluer la continence, de l’expérience de l’équipe réalisant l’intervention et de la technique chirurgicale utilisée.
La continence est généralement définie comme l’absence de port de protection urinaire mais certains auteurs associent à cette définition le port d’une protection de sécurité. Par ailleurs, le taux de continence varie en fonction du temps et s’améliore avec le temps. Ainsi, plus de 90 % des patients sont totalement continents 1 an après l’intervention dans la plupart des études émanant des centres spécialisés alors que seuls 20 à 23 % des patients en moyenne ne portent aucune protection au premier mois postopératoire dans les même études [1]. C’est la raison pour laquelle un traitement chirurgical d’une incontinence post-opératoire n’est habituellement proposé qu’un an après l’intervention.
La technique chirurgicale et l’expérience du chirurgien jouent probablement un rôle décisif dans la continence post-opératoire. De nombreuses modifications de la technique chirurgicale ont été apportées afin d’optimiser les résultats fonctionnels. La prostatectomie radicale peut être effectuée par voie ouverte rétropubienne, périnéale, laparoscopique trans-péritonéale ou prépéritonéale ou par robotique. Cependant actuellement, il n’existe pas d’études randomisées permettant d’établir la supériorité d’une voie d’abord chirurgicale par rapport à l’autre.
Enfin, l’âge des patients pourrait aussi constituer un facteur de risque d’incontinence post-opératoire [6].
L’incontinence urinaire post-prostatectomie radicale est multifactorielle. Elle est classiquement attribuée à une lésion directe de l’appareil sphinctérien urétral ou de son innervation, causant ainsi une incontinence d’effort par incompétence sphinctérienne. Il peut s’y associer une altération des propriétés élastiques de la vessie (diminution de la compliance vésicale) à l’origine d’une augmentation de la pression intravésicale qui se manifeste par une incontinence par urgenturie.
La connaissance des mécanismes physiopathologiques de l’incontinence urinaire post-prostatectomie radicale provient à la fois d’études urodynamiques, anatomiques, radiologiques et électrophysiologiques périnéales.
Groutz et al. [7] ont étudié la fonction urétrale par vidéo urodynamique chez 83 patients présentant une incontinence urinaire après prostatectomie radicale. L’insuffisance sphinctérienne était la cause principale de l’incontinence (88 % des patients). L’hyperactivité détrusorienne était présente chez 33,7 % des patients mais était à elle seule responsable de l’incontinence urinaire dans 7,2% des cas. Dans cette étude, une diminution de la compliance urétrale était notée chez 30,1% des patients.
Les lésions nerveuses à l’origine de l’incontinence urinaire concernent les neurones moteurs du sphincter strié urétral et les fibres sensitives de l’urètre. La préservation des bandelettes neuro-vasculaires péniennes initialement décrite pour préserver les érections post-opératoires est associée à des meilleurs taux de récupération de la continence [8]. Par ailleurs, la préservation de la queue des vésicules séminales qui est au contact des centres nerveux végétatifs pelviens s’accompagnerait de meilleurs taux de continence post-opératoire [9]. Ces résultats témoignent de l’implication d’une lésion indirecte de l’appareil sphinctérien par atteinte de son innervation.
Des études électrophysiologiques ont mis en évidence une diminution de la sensibilité de l’urètre postérieur aux stimuli électriques thermiques et vibratoires après cysto-prostatectomie totale et après prostatectomie radicale [10-13]. Cette perte de sensibilité intra-urétrale pourrait entraîner une abolition du réflexe de contraction sphinctérienne habituellement déclenché par la présence d’urine dans l’urètre. Ceci expliquerait certaines formes d’incontinence urinaire marquées par des écoulements permanents d’urine non précédés d’une sensation de besoin et associés à une préservation de la possibilité d’arrêter volontairement le jet urinaire par mise en action des muscles périnéaux.
L’hypermobilité urétrale dont le rôle physiopathologique est clairement établi dans l’incontinence urinaire féminine pourrait aussi participer au dysfonctionnement vésico-sphinctérien après prostatectomie radicale [14]. En effet, certains auteurs ont rapporté de meilleurs taux de continence post-opératoire en cas de préservation des ligaments pubo-prostatiques et de fixation osseuse de l’anastomose vésico-urétrale. Cependant, cette notion reste à confirmer. Poore et al. n’ont pas retrouvé d’influence sur la continence de la préservation des ligaments puboprostatiques [15]
La conservation d’une longueur fonctionnelle urétrale minimale est une autre notion largement débattue. Une longueur fonctionnelle > 28mm mesurée par examen urodynamique a été considérée comme le seuil nécessaire pour préserver la continence dans une étude sur 17 patients consécutifs [16]. Cependant, d’autres auteurs n’ont pas retrouvé d’influence de ce facteur [17]. Plus récemment, des études IRM ont mis en évidence l’importance de la préservation d’une longueur suffisante d’urètre membraneux (zone du sphincter strié urétrale) et de la taille de la zone de fibrose péri-urétrale dans le mécanisme de la continence urinaire après prostatectomie radicale [18]. Coakley et al. ont évalué par IRM endo-rectale la longueur de l’urètre membraneux en préopératoire et ont conclu qu’une longueur urétrale entre l’apex prostatique et le bulbe pénien supérieure à 12 mm était associée à un retour plus précoce de la continence [8]. La restitution de la partie postérieure du sphincter strié urétral pourrait aussi favoriser un retour rapide de la continence [19].
L’implication possible d’un dysfonctionnement vésical dans la survenue d’une incontinence urinaire post-opératoire est bien documentée par des études urodynamiques mais sa fréquence reste débattue. Une décentralisation vésicale pourrait être à l’origine de la diminution de la compliance vésicale notée chez certains patients [20]. La préservation du col vésical qui participe habituellement à la continence est associée à une récupération plus rapide de la continence à 3 mois, cependant, à long terme le taux d’incontinence n’est pas modifié par rapport aux techniques classiques [21]. Par ailleurs, les différentes techniques de reconstruction ou de préservation du col vésical en queue de raquette donnent des résultats similaires en termes de continence à un an (> 93 %) et des taux identiques de sclérose du col vésical [22].
La prise en charge d’une incontinence après prostatectomie radicale impose d’apprécier l’importance des fuites urinaires et leur retentissement sur la qualité de vie. Plusieurs outils sont disponibles. Il s’agit essentiellement du test de pesée des protections urinaires, de questionnaires simplifiés et validés et du catalogue mictionnel. Si un traitement chirurgical est envisagé, la réalisation d’un bilan urodynamique et d’une exploration morphologique de l’urètre est nécessaire pour préciser le mécanisme de l’incontinence urinaire.
La réalisation d’un test de pesée des protections urinaires (Pad test) sur 1 heure ou sur 24 heures reste la méthode de référence pour évaluer la sévérité de l’incontinence. Il consiste à peser les protections « à sec » puis après un effort standardisé d’une heure ou après une activité quotidienne normale (24 heures exactement). Le calcul du nombre de protection est en pratique souvent associé mais ne donne qu’un reflet très indirect de la quantité d’urines perdues par jour [23].
L’incontinence peut être classifiée en fonction du résultat du test sur 24 heures en une incontinence légère (perte de 1 à 20 g), modérée (21 à 74 g) ou sévère (perte supérieure 75 g) [24]. Selon l’ICS le Pad-test de 1 heure permet de classifier l’incontinence en forme légère (perte de 1 à 10 g), modérée (11 à 50 g) ou sévère (> 51 g).
Le Pad-test sur 24 heures est plus sensible pour dépister une incontinence urinaire que le test sur une heure, cependant la reproductibilité globale des deux test reste imparfaite [25-27].
Il existe des auto-questionnaires validés permettant d’évaluer la sévérité de l’incontinence urinaire, la gène ressentie et le retentissement sur la qualité de vie et les autres symptômes éventuellement associés à l’incontinence.
Le questionnaire ICIQ-SF (voir annexes) comprend 4 questions permettant d’établir un score sur 21 (21 = score le plus défavorable) validé chez l’homme dans le cadre d’une incontinence post-prostatectomie radicale [28]. L’incontinence urinaire peut ainsi être considérée comme légère (score 1-5), modérée (6-12) sévère (13-18) et très sévère (19-21) [29].
Le score ICIQ est corrélé aux résultats du Pad-test de 24 heures [30].
D’autres questionnaires plus récents ont été validés en langue française comme le score UPS qui évalue les symptômes d’incontinence urinaire d’effort, d’hyperactivité vésicale et de dysurie (voir annexes).
Le catalogue mictionnel reste un outil indispensable pour évaluer la sévérité de l’incontinence même s’il reste difficile à interpréter dans la pratique courante. Il consiste à demander au patient de noter sur 3 mictions consécutives, l’horaire et le volume (verre gradué) de chaque miction, le nombre et la circonstance des fuites urinaires et éventuellement la quantité de boisson ingérée. Il renseigne sur la capacité vésicale, la fréquence des besoins et les volumes urinés. Il permet de dépister des habitudes hygiéno-diététiques déviantes et sera utile dans le suivi thérapeutique.
La réalisation d’une urètro-cystoscopie est nécessaire pour vérifier l’absence de sténose urétrale, de bride urétrale, ou d’anomalie intra-vésicale pouvant expliquer un défaut de compliance vésicale. Enfin l’urètro-cystoscopie permet d’apprécier la fibrose urétrale, une sclérose du col vésical et la sensibilité urétrale. La présence d’une fibrose importante du col vésical est un facteur de mauvais pronostic pour un traitement injectable nécessitant une expansion de la muqueuse urétrale.
Enfin le bilan urodynamique doit être réalisé avant tout traitement chirurgical afin de préciser le mécanisme de l’incontinence urinaire : il comprend au minimum une débitmétrie avec mesure du résidu post-mictionnel, une profilométrie urétrale avec mesure de la pression de clôture maximale de l’urètre, une cystomanométrie avec mesures de la capacité et de la sensibilité vésicales et une mesure du leak point pressure (pression intravésicale ou abdominale associée à une fuite d’urine) appréciant la valeur fonctionnelle de l’appareil sphinctérien.
La rééducation pelvi-périnéale reste le traitement de première ligne de l’incontinence urinaire dans la première année suivant la prostatectomie radicale [31-32]. Il permet de renforcer le contrôle vésico-sphinctérien et de corriger une éventuelle inversion de commande. Beaucoup d’urologues recommandent la réalisation de séances de rééducation avant la prostatectomie pour accélérer le retour de la continence post-opératoire [33]. Cependant, cette rééducation préopératoire n’améliorerait pas significativement de taux de continence à un an [33].
Une thérapie comportementale avec réduction des facteurs favorisants (réduction des boissons, des irritants vésicaux (café, épices), miction à heures régulières, contrôle du nombre de mictions par le catalogue mictionnel) est préconisée, cependant, les preuves d’efficacité manquent et il n’y a pas de standardisation des recommandations.
En cas d’hyperactivité détrusorienne, les anticholinergiques doivent être proposés. Les principales molécules disponibles sur le marché sont l’oxybutynine (Ditropan®), le chlorhydrate de trospium (Ceris®), le flavoxate (Urispas®), la toltérodine (Détrusitol®) et la solifénacine (Vesicare®). Le taux de succès des anticholinergiques dans cette indication est mal connu et la conduite à tenir en cas d’échec n’est pas clairement définie (injection intradétrusorienne de toxine botulique, neuromodulation ou agrandissement vésical).
Le traitement médical de l’insuffisance sphinctérienne urétrale qui représente la principale étiologie de l’incontinence urinaire après prostatectomie radicale reste décevant. Le principal traitement pharmacologique dans cette indication est la duloxétine. Il s’agit d’un médicament de la classe des antidépresseurs qui inhibe la recapture de la sérotonine et de la noradrénaline au niveau du noyau d’Onuf. L’augmentation de la concentration de ces deux neurotransmetteurs augmente l’activité des neurones du nerf pudendal, ce qui a pour effet d’accroître l’activité du sphincter strié urétral et de relâcher le détrusor. Filocamo et al. [34] ont évalué 102 patients présentant une incontinence après prostatectomie radicale dans un essai clinique randomisé comparant rééducation pelvienne + duloxétine versus rééducation seule. Cette étude a permis de mettre en évidence un effet synergique de la rééducation sur la prise de duloxétine avec une amélioration du nombre d’épisode d’incontinence et une amélioration de la qualité de vie liée à l’incontinence. Les effets restent cependant modérés.
La duloxétine n’a pas d’autorisation de mise sur le marché en France dans cette indication et n’est pas remboursée par la Sécurité sociale. Les nausées fréquentes représentent le principal effet secondaire. Par ailleurs, cette prescription doit tenir compte des règles générales de prescription des antidépresseurs.
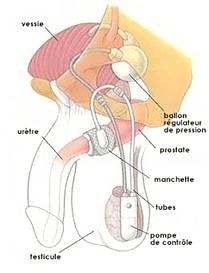
Le sphincter urinaire artificiel est considéré comme le traitement de référence de l’incontinence urinaire par insuffisance sphinctérienne après prostatectomie radicale. Cette intervention doit être réalisée dans des centres urologiques spécialisés car elle nécessite un suivi spécifique et prolongé en raison du taux élevé de reprises chirurgicales. Il n’existe actuellement qu’un seul dispositif sur le marché : l’American Medical Systems 800 (AMS 800™) (figure 1).
Le sphincter artificiel est composé de trois parties connectées par un système de tubulure :

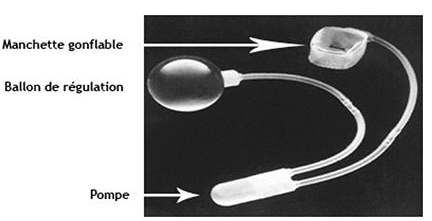
FIGURE 1 : Le sphincter artificiel AMS 800
L’occlusion urétrale est assurée de façon automatique et permanente par la manchette occlusive. La miction est déclenchée de manière volontaire en exerçant quelques pressions sur la poire de la pompe. Cette manœuvre provoque le transfert du liquide contenu dans la manchette vers le ballon régulateur de pression. La manchette reste ouverte durant quelques minutes pour permettre d’uriner, puis se pressurise à nouveau, le liquide retournant automatiquement vers la manchette pour restaurer l’occlusion urétrale.
Le taux de continence après implantation de sphincter urinaire artificiel varie entre 80 et 96 % des cas en fonction des études et de la définition de la continence [35]. La mise en place d’un sphincter urinaire artificiel nécessite un minimum de dextérité manuelle et de capacité mentale pour comprendre son fonctionnement. Par ailleurs, le sphincter expose à des complications infectieuses ou des érosions d’un des composants aboutissant à l’explantation du sphincter en totalité. Le taux global de révision du matériel pour dysfonctionnement (ex : dépressurisation) est de 12 % et le taux d’infection ou d’érosion précoce est de 4,5 %. A long terme, le sphincter artificiel peut entraîner une atrophie urétrale à l’origine d’une érosion tardive (15 %) ou d’une récidive de l’incontinence (7 %).
Une sténose de l’anastomose urétrovésicale peut s’associer à l’insuffisance sphinctérienne après prostatectomie radicale et nécessite d’être traitée avant de mettre en place le sphincter artificiel.
Une altération de la compliance vésicale peut retentir sur le haut appareil urinaire si elle n’est pas traitée avant la mise en place du sphincter. Cependant, le traitement d’une hypocompliance vésicale reste mal codifié dans ce contexte. La réalisation d’une entérocystoplastie d’agrandissement augmente le risque d’infection du sphincter et nécessite l’apprentissage des autosondages. Les injections intradétrusoriennes de toxine botulique pourraient représenter une alternative intéressante mais restent à évaluer.
Les antécédents de radiothérapie pelvienne sont classiquement associés à des taux plus élevés de complications et de moins bons résultats fonctionnels du sphincter artificiel. Cependant, les études récentes n’ont pas retrouvé d’incidence de la radiothérapie sur les résultats du sphincter. Gomha et al. [36] ont étudié un groupe de 86 patients porteurs d’un sphincter artificiel dont 28 avaient des antécédents radiothérapie pelvienne. Les résultats en termes de taux de d’atrophie urétrale (14 % vs 14 % ), d’infection du matériel (7 % vs 0 %) de continence (60 % vs 64 %) et de réintervention (22,4 % vs 25 %) n’étaient pas significativement différents chez les patients sans/avec antécédent de radiothérapie.
La radiothérapie pelvienne ne constitue donc pas une contre-indication à la mise en place d’un sphincter artificiel. Il est important de garder cette notion à l’esprit car les autres traitements chirurgicaux de l’incontinence urinaire après prostatectomie radicale perdent leur efficacité, voire sont contre-indiqués en cas d’antécédents de radiothérapie.
En cas d’atrophie de l’urètre ou d’incontinence urinaire persistante, plusieurs options thérapeutiques ont été proposées : il s’agit de la mise en place d’une manchette de plus petit diamètre en lieu et place de la première manchette, le remplacement du ballon régulateur de pression, la mise en place d’une deuxième manchette branchée en Y permettant d’assurer une double compression de l’urètre.
Enfin, en cas d’atrophie ou de fragilité urétrale importante laissant présager une érosion précoce de l’urètre, il a été proposé de placer la manchette compressive à travers les corps caverneux afin d’interposer une plus grande épaisseur de tissu entre la manchette et l’urètre.
L’objectif des injections péri-urétrales de substances comblantes est d’augmenter la coaptation urétrale pour accroître la résistance à l’écoulement des urines.
Les principales substances ayant été testées sont, le polytétrafluoroéthylène-PTFE (Téflon®), le collagène bovin (Contigen®), le silicone (Macroplastique®), le carbone zirconium (Durasphere®), l’acide hyaluronique/dextranomer (Zuidex®) et la graisse autologue. En France, le produit le plus utilisé est le Macroplastique® qui est constitué de silicone élastomère, le polydiméthylsiloxane (PDMS), en suspension dans un gel non siliconé de polyvinylpyrrolidone (PVD). Le PDMS est constitué de particules de taille moyenne de 156,5 μm. Le Macroplastique® a la caractéristique d’être non résorbable et ne migre pas dans les tissus comme cela a été décrit pour le Téflon®.
La technique consiste à injecter la substance par voie endoscopique sous la muqueuse urétrale au niveau du col vésical de manière à obtenir un comblement de la lumière urétrale. Les injections peuvent éventuellement être répétées pour compléter l’effet.
Il n’y a pas de contre-indications aux injections périurétrales en dehors de l’allergie aux produits utilisés en particulier pour le collagène bovin qui nécessite au préalable un test de sensibilité. Lorsque la zone d’injection présente un aspect fibreux, l’injection peut s’avérer difficile ou sans effet car la fibrose ne permet pas de créer un bombement obstructif de la muqueuse urétrale.
Globalement, le taux de continence rapporté chez l’homme après injection de Macroplastique se dégrade avec le temps et nécessite des injections itératives. Bugel et al. [37] ont rapporté des taux de continence de 26 % à 1 an dans cette indication. Wesney et al. [38] ont étudié une populations de 322 hommes traités par injection de macroplastiques avec un suivi moyen de 40,1 mois. En moyenne, les patients ont reçu 4,37 injections. Le nombre de protections avant et après injection était respectivement de 5,15 vs 2,98 (p = 0,0001). Seuls 17 % des patients étaient complètement continents après injection avec une durée moyenne de réponse de 11 mois.
Ce traitement s’adresse à des formes d’incontinence urinaire modérées avec un urètre non fibreux.
La mise en place de ballons péri-urétraux a été introduite par Hübner et Schlarp en 2005 [39] pour comprimer l’urètre dans la région du sphincter externe strié déficient. Il s’agit d’un système de deux ballons en silicone reliés par une tubulure de 14 cm à un port en titane permettant de remplir ou de vider le ballon avec un mélange isotonique radio-opaque (figure 2). Ces ballons sont implantés par voie percutanée à travers le périnée de part et d’autre de l’urètre sous le col vésical et sous contrôle radioscopique dans des conditions d’asepsie rigoureuse. Après insertion des ballons, les tubulures sont placées sous la peau scrotale de manière à être palpables par l’examinateur ultérieurement. Cinq semaines après l’intervention (temps de cicatrisation et de formation d’une coque fibreuse autour des ballons), le volume de chaque ballon est ajusté selon le résultat focntionnel observé par ponction percutanée du port. Un millilitre de sérum physiologique est ainsi injecté dans chaque tubulure toutes les semaines en ambulatoire jusqu’à obtenir une continence optimale. Chaque ballon peut recevoir 8 cm au total. Si les ballons sont trop gonflés et dysuriants, ils peuvent être dégonflés par simple ponction.
Ce traitement présente donc les avantages d’être ajustable et réversible. Les inconvénients sont essentiellement l’absence d’amélioration immédiate pendant la phase d’ajustement.
Récemment, certains auteurs ont proposé la mise en place de ballons sous anesthésie locale et contrôle échographique avec un suivi moyen de 2 ans chez 79 patients incontinents [40]. Au total, 41 des patients traités étaient continents (66,1 %), 16 patients améliorés (25,8 %) et 5 en échec (8 %). Le taux de continence était de 85 %, 63,6 %, and 33,3 % respectivement chez les patients présentant une incontinence légère, modérée, sévère et de 35,7 % en cas d’antécédents de radiothérapie pelvienne. Les principales complications rapportées étaient les perforations vésicales, les retentions urinaires temporaires et la migration secondaire des ballons et l’érosion urétrale. Ces complications n’entraînent pas de séquelles et ne gênent pas la réalisation ultérieure d’un autre traitement chirurgical.
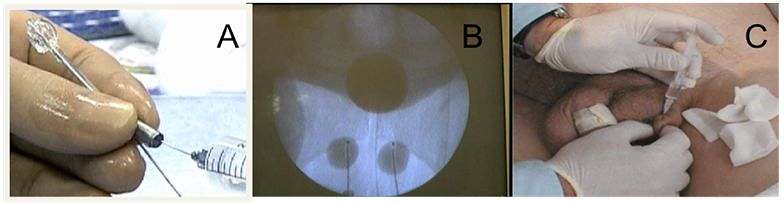
FIGURE 2 : Les ballons proACT. A : aspect d’un ballon avec sa tubulure et son embout en titane permettant le gonflement du ballon à distance. B : placement des ballons à proximité de l’urètre sous contrôle scopique (les ballons sont gonflés avec une solution isotonique de produit de contraste et la vessie est repérée par une sonde vésicale dont le ballonnet est rempli de produit de contraste non dilué). C : 5 semaines après l’intervention, les ballons peuvent commencer à être gonflés par voie percutanée grâce aux tubulures enfouies dans la peau du scrotum.
Les bandelettes sous-urétrales représentent avec les ballons proACT l’une des deux stratégies thérapeutiques mini invasives pour les formes d’incontinence urinaire modérée en alternative au sphincter artificiel. Il est à noter qu’aucun de ces traitements n’empêche la mise en place ultérieure d’un sphincter artificiel en cas d’échec.
La bandelette sous-urétrale est mise en place par voie périnéale sous l’urètre bulbaire et exerce à ce niveau une pression constante compensant la faiblesse sphinctérienne. Parmi les modèles les plus utilisés, on distingue les bandelettes Invance®, Advence®, I-Stop® et la bandelette ajustable Remeex®.
Les premières bandelettes utilisées étaient maintenues à leurs extrémités latérales par un ancrage osseux vissé sur les branches ischiopubiennes (Invance®). Cependant, en raison des migrations fréquentes des vis, cette technique a été progressivement remplacée par un passage de la bandelette à travers les foramens obturés (Advence®). La bandelette est alors maintenue en place par un fort coefficient de friction avec les tissus musculaires et aponévrotiques traversés (Figure 3).
Le taux de guérison rapporté avec cette technique (0 protection) sont très prometteurs et varient entre 43 et 65 % selon les séries avec un recul de 6 mois à un an [41-43]. La simplicité de la technique et le résultat immédiat sont les principaux avantages.
Une bandelette sous-urétrale ajustable a été développée sous le nom de MRS (Male Remeex Sling). La caractéristique de cette bandelette mise en place par voie rétropubienne est qu’elle peut être ajustée en post-opératoire par l’intermédiaire d’un petit boîtier temporaire placé en avant du pubis. Après un recul moyen de 32 mois, le taux de succès (0 garniture) rapporté est de 64,7 % et le taux de continence (0 ou 1 garniture) de 80,4 % [44].
Les principales complications sont la rétention post-opératoire, l’infection du site opératoire et les douleurs périnéales. Le taux d’érosion urétrale à long terme n’est pas encore connu. Enfin, la radiothérapie est reconnue comme un facteur important d’échec des bandelettes sous-urétrales si bien que beaucoup d’auteurs la contre-indiquent dans cette situation.
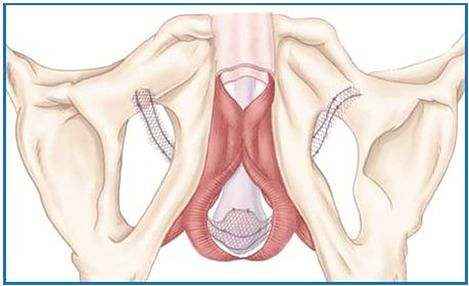
FIGURE 3 : Représentation schématique de la bandelette sous-urétrale passée par voie trans-obturatrice et exerçant une compression de l’urètre bulbaire
Récemment, de nouvelles thérapies de type cellulaire ont été mises au point chez l’animal [45-46] et certaines ont fait l’objet d’essais cliniques. L’objectif général est d’augmenter la tonicité urétrale en agissant soit sur la composante lisse de l’appareil sphinctérien urétral soit sur la composante striée. Plusieurs sources de cellules ont été utilisées dans le but d’augmenter la quantité de cellules musculaires lisses exerçant une activité tonique basale dans la paroi urétrale. Il s’agit des cellules souches médullaires, les cellules amniotiques [47] ou les cellules souches du tissu adipeux [48]. Chacun de ces types cellulaires a la capacité de se différencier spontanément en cellules musculaires lisses après avoir été injecté dans la paroi urétrale et pourrait donc avoir une indication dans l’incontinence urinaire après prostatectomie radicale.
L’injection de cellules précurseurs de muscle strié reste à ce jour l’approche ayant fait l’objet du plus grand nombre d’investigations et a débouché sur des essais cliniques.
L’idée de greffer des cellules précurseurs de muscle strié dans un sphincter strié déficient découle directement de la recherche sur les myopathies génétiques qui a permis d’élucider les mécanismes de la régénération musculaire. Les cellules précurseurs de muscle strié ont ainsi été mises en évidence et caractérisées à des fins thérapeutiques. Ces découvertes ont apporté des espoirs de traitement par thérapie cellulaire pour les myopathies génétiquement déterminées [49] et acquises, au premier rang desquelles figurent l’insuffisance cardiaque [50] et plus récemment, l’incontinence urinaire.
Une nouvelle approche de la thérapie cellulaire par greffe de cellules précurseurs des muscles striés consiste à implanter chirurgicalement des fibres musculaires avec leurs cellules satellites à proximité de la zone sphinctérienne sans phase de culture cellulaire. Cette stratégie repose sur le potentiel régénératif naturel des cellules satellites (les principales cellules précurseurs) et notamment sur l’hypothèse selon laquelle l’absence de processus d’extraction ou de culture augmente le potentiel myogénique des cellules ainsi implantées dans l’urètre. Des études préliminaires chez le gros animal ont montré que les fibres musculaires dégénèrent rapidement après leur implantation dans la paroi urétrale, ce qui déclenche l’activation des cellules satellites. Après un mois, l’ensemble de fibres parentales sont reconstituées à partir des cellules satellites filles et exercent d’authentiques contractions toniques et sous commande nerveuse.[46]
Cette stratégie permet d’effectuer l’ensemble de la procédure (prélèvement cellulaire et greffe) en un temps au bloc opératoire pour générer un nouveau sphincter.
La physiopathologie de l’incontinence urinaire après prostatectomie radicale est complexe. Elle peut associer des lésions du sphincter strié urétral et un trouble de la compliance vésicale. Le sphincter urinaire artificiel reste le traitement de référence pour les incontinences sévères d’origine sphinctérienne. Cependant, le taux de complication est non négligeable et cette intervention ne se justifie pas dans les formes d’incontinence modérées ou légères. C’est dans ces formes intermédiaires que la mise en place d’une bandelette sous-urétrale ou de ballons proACt doit être proposée. Les injections péri-urétrales permettent une amélioration de la continence chez les patients avec une incontinence urinaire minime ou chez ceux qui ne peuvent pas bénéficier d’autres techniques.
A l’avenir, l’uniformisation de la définition de la sévérité de l’incontinence permettra d’affiner les indications des différents traitements. Par ailleurs de nouvelles stratégies thérapeutiques par greffe de cellules souches sont en cours d’investigation.
1 Salomon L, Anastasiadis AG, Katz R, De La Taille A, Saint F, Vordos D, Cicco A, Hoznek A, Chopin D, Abbou CC. Urinary continence and erectile function: a prospective evaluation of functional results after radical laparoscopic prostatectomy. Eur Urol 2002;42:338-43.
2 Augustin H, Pummer K, Daghofer F, Habermann H, Primus G, Hubmer G. Patient self-reporting questionnaire on urological morbidity and bother after radical retropubic prostatectomy. European urology 2002;42:112-17.
3 Goeman L, Salomon L, La De Taille A, Vordos D, Hoznek A, Yiou R, Abbou CC. Long-term functional and oncological results after retroperitoneal laparoscopic prostatectomy according to a prospective evaluation of 550 patients. World J Urol 2006;24:281-8.
4 Drouin SJ, Vaessen C, Misrai V, Ferhi K, Bitker MO, Chartier-Kastler E, Haertig A, Richard F, Roupret M. [Oncologic and functional outcomes after robot-assisted laparoscopic radical prostatectomy]. Prog Urol 2009;19:158-64.
5 Anastasiadis AG, Salomon L, Katz R, Hoznek A, Chopin D, Abbou CC. Radical retropubic versus laparoscopic prostatectomy: a prospective comparison of functional outcome. Urology 2003;62:292-7.
6 Kundu SD, Roehl KA, Eggener SE, Antenor JA, Han M, Catalona WJ. Potency, continence and complications in 3,477 consecutive radical retropubic prostatectomies. The Journal of urology 2004;172:2227-31.
7 Groutz A, Blaivas JG, Chaikin DC, Weiss JP, Verhaaren M. The pathophysiology of post-radical prostatectomy incontinence: a clinical and video urodynamic study. J Urol 2000;163:1767-70.
8 Catalona WJ, Basler JW. Return of erections and urinary continence following nerve sparing radical retropubic prostatectomy. The Journal of urology 1993;150:905-7.
9 John H, Hauri D. Seminal vesicle-sparing radical prostatectomy: a novel concept to restore early urinary continence. Urology 2000;55:820-4.
10 Hansen MV, Ertekin C, Larsson LE, Pedersen K. A neurophysiological study of patients undergoing radical prostatectomy. Scand J Urol Nephrol 1989;23:267-73.
11 Hugonnet CL, Danuser H, Springer JP, Studer UE. Decreased sensitivity in the membranous urethra after orthotopic ileal bladder substitute. J Urol 1999;161:418-21.
12 Hugonnet CL, Danuser H, Springer JP, Studer UE. Urethral sensitivity and the impact on urinary continence in patients with an ileal bladder substitute after cystectomy. J Urol 2001;165:1502-5.
13 John H, Hauri D, Leuener M, Reinecke M, Maake C. Evidence of trigonal denervation and reinnervation after radical retropubic prostatectomy. J Urol 2001;165:111-3.
14 Noguchi M, Shimada A, Nakashima O, Kojiro M, Matsuoka K. Urodynamic evaluation of a suspension technique for rapid recovery of continence after radical retropubic prostatectomy. Int J Urol 2006;13:373-8.
15 Poore RE, McCullough DL, Jarow JP. Puboprostatic ligament sparing improves urinary continence after radical retropubic prostatectomy. Urology 1998;51:67-72.
16 Rudy DC, Woodside JR, Crawford ED. Urodynamic evaluation of incontinence in patients undergoing modified Campbell radical retropubic prostatectomy: a prospective study. J Urol 1984;132:708-12.
17 Kleinhans B, Gerharz E, Melekos M, Weingartner K, Kalble T, Riedmiller H. Changes of urodynamic findings after radical retropubic prostatectomy. Eur Urol 1999;35:217-21; discussion 21-2.
18 Paparel P, Akin O, Sandhu JS, Otero JR, Serio AM, Scardino PT, Hricak H, Guillonneau B. Recovery of urinary continence after radical prostatectomy: association with urethral length and urethral fibrosis measured by preoperative and postoperative endorectal magnetic resonance imaging. Eur Urol 2009;55:629-37.
19 Rocco B, Gregori A, Stener S, Santoro L, Bozzola A, Galli S, Knez R, Scieri F, Scaburri A, Gaboardi F. Posterior reconstruction of the rhabdosphincter allows a rapid recovery of continence after transperitoneal videolaparoscopic radical prostatectomy. Eur Urol 2007;51:996-1003.
20 Hellstrom P, Lukkarinen O, Kontturi M. Urodynamics in radical retropubic prostatectomy. Scand J Urol Nephrol 1989;23:21-4.
21 Wille S, Varga Z, von Knobloch R, Hofmann R. Intussusception of bladder neck improves early continence after radical prostatectomy: results of a prospective trial. Urology 2005;65:524-7.
22 Poon M, Ruckle H, Bamshad BR, Tsai C, Webster R, Lui P. Radical retropubic prostatectomy: bladder neck preservation versus reconstruction. J Urol 2000;163:194-8.
23 Dylewski DA, Jamison MG, Borawski KM, Sherman ND, Amundsen CL, Webster GD. A statistical comparison of pad numbers versus pad weights in the quantification of urinary incontinence. Neurourol Urodyn 2007;26:3-7.
24 O’Sullivan R, Karantanis E, Stevermuer TL, Allen W, Moore KH. Definition of mild, moderate and severe incontinence on the 24-hour pad test. Bjog 2004;111:859-62.
25 Lose G, Jorgensen L, Thunedborg P. 24-hour home pad weighing test versus 1-hour ward test in the assessment of mild stress incontinence. Acta obstetricia et gynecologica Scandinavica 1989;68:211-5.
26 Simons AM, Yoong WC, Buckland S, Moore KH. Inadequate repeatability of the one-hour pad test: the need for a new incontinence outcome measure. Bjog 2001;108:315-9.
27 Matharu GS, Assassa RP, Williams KS, Donaldson M, Matthews R, Tincello DG, Mayne CJ. Objective assessment of urinary incontinence in women: comparison of the one-hour and 24-hour pad tests. European urology 2004;45:208-12.
28 Twiss CO, Fischer MC, Nitti VW. Comparison between reduction in 24-hour pad weight, International Consultation on Incontinence-Short Form (ICIQ-SF) score, International Prostate Symptom Score (IPSS), and Post-Operative Patient Global Impression of Improvement (PGI-I) score in patient evaluation after male perineal sling. Neurourol Urodyn 2007;26:8-13.
29 Klovning A, Avery K, Sandvik H, Hunskaar S. Comparison of two questionnaires for assessing the severity of urinary incontinence: The ICIQ-UI SF versus the incontinence severity index. Neurourology and urodynamics 2009;28:411-5.
30 Karantanis E, Fynes M, Moore KH, Stanton SL. Comparison of the ICIQ-SF and 24-hour pad test with other measures for evaluating the severity of urodynamic stress incontinence. International urogynecology journal and pelvic floor dysfunction 2004;15:111-6; discussion 16.
31 Hay-Smith J, Herbison P, Morkved S. Physical therapies for prevention of urinary and faecal incontinence in adults. Cochrane Database Syst Rev 2002:CD003191.
32 Moore KN, Cody DJ, Glazener CM. Conservative management for post prostatectomy urinary incontinence. Cochrane Database Syst Rev 2001:CD001843.
33 Hunter KF, Moore KN, Cody DJ, Glazener CM. Conservative management for postprostatectomy urinary incontinence. Cochrane database of systematic reviews (Online) 2004:CD001843.
34 Filocamo MT, Li Marzi V, Del Popolo G, Cecconi F, Villari D, Marzocco M, Nicita G. Pharmacologic treatment in postprostatectomy stress urinary incontinence. European urology 2007;51:1559-64.
35 Hussain M, Greenwell TJ, Venn SN, Mundy AR. The current role of the artificial urinary sphincter for the treatment of urinary incontinence. The Journal of urology 2005;174:418-24.
36 Gomha MA, Boone TB. Artificial urinary sphincter for post-prostatectomy incontinence in men who had prior radiotherapy: a risk and outcome analysis. The Journal of urology 2002;167:591-6.
37 Bugel H, Pfister C, Sibert L, Cappele O, Khalaf A, Grise P. [Intraurethral Macroplastic injections in the treatment of urinary incontinence after prostatic surgery]. Prog Urol 1999;9:1068-76.
38 Westney OL, Bevan-Thomas R, Palmer JL, Cespedes RD, McGuire EJ. Transurethral collagen injections for male intrinsic sphincter deficiency: the University of Texas-Houston experience. The Journal of urology 2005;174:994-7.
39 Hubner WA, Schlarp OM. Treatment of incontinence after prostatectomy using a new minimally invasive device: adjustable continence therapy. BJU international 2005;96:587-94.
40 Gregori A, Romano AL, Scieri F, Pietrantuono F, Incarbone GP, Salvaggio A, Granata A, Gaboardi F. Transrectal ultrasound-guided implantation of Adjustable Continence Therapy (ProACT): surgical technique and clinical results after a mean follow-up of 2 years. European urology;57:430-6.
41 Grise P, Geraud M, Geraud M, Lienhart J, Le Portz B, Bubenheim M, Costa P. Transobturator male sling TOMS for the treatment of stress post-prostatectomy incontinence, initial experience and results with one year’s experience. Int Braz J Urol 2009;35:706-13; discussion 14-5.
42 De Leval J, Waltregny D. The inside-out trans-obturator sling: a novel surgical technique for the treatment of male urinary incontinence. European urology 2008;54:1051-65.
43 Cornu JN, Sebe P, Ciofu C, Peyrat L, Beley S, Tligui M, Lukacs B, Traxer O, Cussenot O, Haab F. The AdVance Transobturator Male Sling for Postprostatectomy Incontinence: Clinical Results of a Prospective Evaluation after a Minimum Follow-up of 6 Months. European urology 2009.
44 Sousa-Escandon A, Cabrera J, Mantovani F, Moretti M, Ioanidis E, Kondelidis N, Neymeyer J, Noguera R. Adjustable suburethral sling (male remeex system) in the treatment of male stress urinary incontinence: a multicentric European study. European urology 2007;52:1473-9.
45 Yiou R, Yoo JJ, Atala A. Restoration of functional motor units in a rat model of sphincter injury by muscle precursor cell autografts. Transplantation 2003;76:1053-60.
46 Lecoeur C, Swieb S, Zini L, Riviere C, Combrisson H, Gherardi R, Abbou C, Yiou R. Intraurethral transfer of satellite cells by myofiber implants results in the formation of innervated myotubes exerting tonic contractions. J Urol 2007;178:332-7.
47 De Coppi P, Callegari A, Chiavegato A, Gasparotto L, Piccoli M, Taiani J, Pozzobon M, Boldrin L, Okabe M, Cozzi E, Atala A, Gamba P, Sartore S. Amniotic fluid and bone marrow derived mesenchymal stem cells can be converted to smooth muscle cells in the cryo-injured rat bladder and prevent compensatory hypertrophy of surviving smooth muscle cells. J Urol 2007;177:369-76.
48 Jack GS, Almeida FG, Zhang R, Alfonso ZC, Zuk PA, Rodriguez LV. Processed lipoaspirate cells for tissue engineering of the lower urinary tract: implications for the treatment of stress urinary incontinence and bladder reconstruction. J Urol 2005;174:2041-5.
49 Gussoni E, Soneoka Y, Strickland CD, Buzney EA, Khan MK, Flint AF, Kunkel LM, Mulligan RC. Dystrophin expression in the mdx mouse restored by stem cell transplantation. Nature 1999;401:390-4.
50 Menasche P, Hagege AA, Scorsin M, Pouzet B, Desnos M, Duboc D, Schwartz K, Vilquin JT, Marolleau JP. Myoblast transplantation for heart failure. Lancet 2001;357:279-80.
Coakley F.V., Eberhardt S., Kattan M.W., Wei D.C., Scardino P.T., Hricak H. Urinary continence after radical retropubic prostatectomy: relationship with membranous urethral length on preoperative endorectale magnetic resonance imaging J. Urol. 2002 ; 168 : 1032-1035
ANNEXES
QUESTIONNAIRE ICIQ
Au cours des 4 dernières semaines :
0 1 2 3 4 5 6 7 8 9 10
TOTAL SCORE TOTAL ICIQ (Questions 1+2+3)=…………/21
SCORE USP
Il peut vous arriver d’avoir des fuites d’urine lors de certains efforts physiques, soit importants (tels qu’une pratique sportive ou une quinte de toux violente), soit modérées (tels que monter ou descendre les escaliers ou encore légers (tels que la marche ou un changement de position).
Durant les 4 dernières semaines, pouvez-vous préciser le nombre de fois par semaine ou vous avez eu des fuites au cours d’efforts physiques (Cocher une case pour chacune des lignes 1a, 1b, et 1c.) :
|
Jamais de fuite d’urine |
Moins d’une fuite d’urine par semaine |
Plusieurs fuites d’urine par semaine |
Plusieurs fuites d’urine par jour. | |
|
1a . lors des efforts physiques importants |
0 |
1 |
2 |
3 |
|
1 b. lors des efforts physiques modérés |
0 |
1 |
2 |
3 |
|
1c. lors des efforts physiques légers |
0 |
1 |
2 |
3 |
Partie réservée au médecin : reporter sur l’échelle ci-dessous la somme des items 1a, 1b, 1c
0 1 2 3 4 5 6 7 8 9
SCORE « INCONTINENCE URINAIRE A L’EFFORT
Durant ces 4 dernières semaines et dans les conditions habituelles de vos activités sociales, professionnelles ou familiales :
2 – Combien de fois par semaine avez-vous dû vous précipiter aux toilettes pour uriner en raison d’un besoin urgent ?
|
0 Jamais |
1 Moins d’une fois par semaine |
2 Plusieurs fois par semaine |
3 Plusieurs fois par jour |
3 – Quand vous êtes pris par un besoin urgent d’uriner, combien de minutes en moyenne pouvez-vous vous retenir ?
|
0 Plus de 15 mn |
1 de 6 à 15 mn |
2 de 1 à 5 mn |
3 Moins de 1 mn |
4 – Combien de fois par semaine avez-vous eu une fuite d’urine précédée d’un besoin urgent d’uriner que vous n’avez pas pu contrôler ?
|
0 Jamais |
1 Moins d’une fois par semaine |
2 Plusieurs fois par semaine |
3 Plusieurs fois par jour |
4 bis – Dans ces circonstances, quel type de fuites avez-vous ?
|
0 Pas de fuites dans cette circonstance |
1 quelques gouttes |
2 fuites en petites quantités |
3 fuites inondantes |
Durant ces 4 dernières semaines et dans les conditions habituelles de vos activités sociales, professionnelles ou familiales :
5 – Pendant la journée, quel est le temps habituel espaçant deux mictions (action d’uriner ?)
|
0 Deux heures ou plus |
1 Entre 1 h et 2 h |
2 entre 30 mn et 1 h |
3 moins de 30 mn |
6 – Combien de fois en moyenne avez-vous été réveillée la nuit par un besoin d’uriner ?
|
0 0 ou 1 fois |
1 2 fois |
2 3 ou 4 fois |
3 plus de 4 fois |
7 – Combien de fois par semaine avez-vous eu une fuite d’urine en dormant ou vous êtes-vous réveillé(e)
mouillé(e)
|
0 Jamais |
1 moins d’une fois Par semaine |
2 plusieurs fois par semaine |
3 plusieurs fois par jour |
Partie réservée au médecin : reporter sur l’échelle –ci-dessous la somme des items 2+3+4+4bis+5+6+7
SCORE « HYPERACTIVITE VESICALE »
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21
Durant ces 4 dernières semaines et dans les conditions habituelles de vos activités sociales, professionnelles ou familiales :
8 – Comment décrivez-vous votre miction (action d’uriner) habituelle durant ces 4 dernières semaines ?
|
0 Normale |
1 Nécessité de pousser avec les muscles abdominaux (du ventre) ou miction penchée en avant (ou nécessitant un changement de position) |
2 Nécessité d’appuyer sur le bas ventre avec les mains |
3 Vidange par sonde urinaire |
9 – En général, comment décririez-vous votre jet d’urine ?
|
0 Normal |
1 Jet faible |
2 Goutte à goutte |
3 Vidange par sonde urinaire |
10 – En général, comment s’effectue votre miction (action d’uriner) ?
|
0 Miction normale et rapide |
1 Miction difficile à débuter puis s’effectuant normalement |
1 Miction débutant facilement mais longue à terminer |
2 Miction très lente du début jusqu’à la fin |
3 Vidange par sonde urinaire |
Partie réservée au médecin : reporter sur l’échelle ci-dessous la somme des items 8+9+10
0 1 2 3 4 5 6 7 8 9
SCORE « DYSURIE »